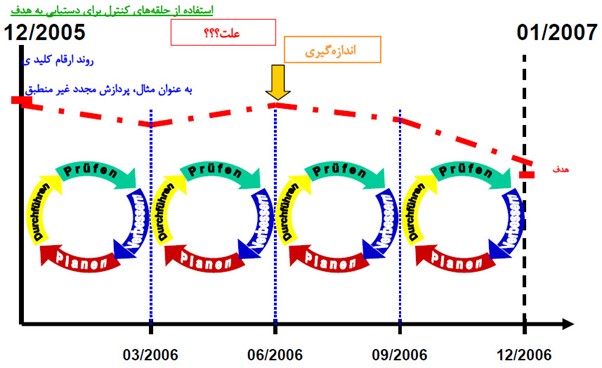
مدیریت فرآیند معتبر (توضیح داده شده در بخش قبلی) با این واقعیت مشخص میشود که سازمان تمام فرآیندهای مربوطه را تعریف، ترسیم و معرفی کرده و فرآیندهای اصلی را با ارقام کلیدی مربوطه مجهز ساخته است. سازمان به لطف این ابزار میتواند به شیوۀ انتخابی و سازمانیافته توسعه یابد.
Prüfen = تست / Verbessen = بهبود / Planen = طرح / Durchführen = اجرا
«فرآیند ویژه»
اصطلاح «فرآیند ویژه» در صورتی در مدیریت کیفیت مورد استفاده قرار میگیرد که نتوان نتیجۀ فرآیند، یعنی؛ کیفیت محصول را اندازهگیری کرد. از این رو، پردازش مجدد لوازم استریل، نوعی «فرآیند ویژه» را تشکیل میدهد.
در چنین حالتی، تمام مراحل فرآیند باید به طور ماهرانه تنظیم، سازماندهی، نظارت و مستند شود تا بتوان فرض کرد که کیفیت محصول با رعایت تمام دستورالعملها برابر با محصولات استریل است.
دستورالعمل ONR 112069 اتریش
ONR 112069 به عنوان یک مثال در نظر گرفته شده است.
دستورالعمل ONR 112069 اتریش، در مورد اعتبارسنجی و نظارت معمول فرآیندهای استریلیزاسیون با گرمای مرطوب برای تجهیزات پزشکی به سه بخش تقسیم میشود:
بخش 1
بخش 1، بخشی کلی است که شامل موارد زیر میباشد:
1: مقدمه
2: مبانی حقوقی
3: اصول مدیریت فرآیند
1-3: سازمان ساختاری
2-3: سازمان رویهای
3-3: انواع فرآیند
4-3: تعریف فرآیند
5-3: ارزیابی فرآیندها
6-3: تصویرسازی فرآیندها
7-3: نمودار جریان
8-3: روش کار با اسناد مشخص شده
9-3: کنترل مدیریت کسب و کار
10-3: «فرآیند ویژه»
4: دستورالعمل ONR 112069 اتریش
بخش 1
بخش 2
بخش 3
1-4: اجرای ONR 112069
Re 1) اطلاعات عمومی
Re 2) وضعیت ساختاری / فضایی
Re 2.2) ابزارآلات و لوازم
Re 2.3) سازمان
شرح شغل
Re 2.4) صلاحیت / آموزش کارکنان
Re 2.5) بهداشت عمومی (کنترل عفونت)
Re 2.6) ایمنی شغلی
Re 3) تضمین / مدیریت کیفیت
Re 3.1) کلیات
Re 3.2) دستگاههای شستشو – ضدعفونیکننده (WDs)
Re 3.3) دستگاههای استریلکننده
Re 3.4) ذخیرهسازی لوازم استریل
Re 3.5) رویههای عملیاتی استاندارد (SOP)
Re 3.6) مستندسازی
2-4: آنالیز اندازهگیری، بهبود
3-4: فرآیندهای مرتبط با مخاطب
5: پیوست
1-5: استانداردها
2-5: پیوندها
بخش 2
بخش 2، «ویژگیهای بیشتر» را توضیح میدهد. این موارد، عبارتاند از:
1: مقدمه
2: مبانی حقوقی
3: اصول مدیریت فرآیند
1-3: سازمان ساختاری
2-3: سازمان رویهای
3-3: انواع فرآیند
4-3: تعریف فرآیند
5-3: ارزیابی فرآیندها
6-3: تصویرسازی فرآیندها
7-3: نمودار جریان
8-3: روش کار با اسناد مشخص شده
9-3: کنترل مدیریت کسب و کار
10-3: «فرآیند ویژه»
4: دستورالعمل ONR 112069 اتریش
بخش 1
بخش 2
بخش 3
1-4: اجرای ONR 112069
Re 1) اطلاعات عمومی
Re 2) وضعیت ساختاری / فضایی
Re 2.2) ابزارآلات و لوازم
Re 2.3) سازمان
شرح شغل
Re 2.4) صلاحیت / آموزش کارکنان
Re 2.5) بهداشت عمومی (کنترل عفونت)
Re 2.6) ایمنی شغلی
Re 3) تضمین / مدیریت کیفیت
Re 3.1) کلیات
Re 3.2) دستگاههای شستشو – ضدعفونیکننده (WDs)
Re 3.3) دستگاههای استریلکننده
Re 3.4) ذخیرهسازی لوازم استریل
Re 3.5) رویههای عملیاتی استاندارد (SOP)
Re 3.6) مستندسازی
2-4: آنالیز اندازهگیری، بهبود
3-4: فرآیندهای مرتبط با مخاطب
5: پیوست
1-5: استانداردها
2-5: پیوندها
بخش 3
بخش 3 مهمترین مورد برای RUMED است، زیرا جنبههای سازمانی RUMED را مشخص میکند. زمینههای دارای پسزمینۀ خاکستری، ضروری هستند، یعنی این الزامات باید در زمان اعتبارسنجی برآورده شوند. بنابراین توصیه میشود که ابتدا فرآیندها را تعریف کنیم تا ارتباطات بین آنها قابل مشاهده باشد، زیرا عموماً مفاد ONR 112069 توسط حوزههای مختلف (بخش مدیریت، مهندسی) تدوین میشوند.
بخش 3 به سازمان ساختاری و رویهای و همچنین ابزارآلات و لوازم RUMED مربوط است. بخش 3، مانند نوعی چکلیست طراحی شده است و شامل موارد زیر میباشد:
اجرای ONR 112069
فصل زیر نگاه دقیقتری به مفاد ONR 112069-3 از منظر QM دارد و در عین حال نمونههایی از راهحلها را ارائه میدهد.
راهاندازی
مشخصات عمومی و پیششرطها
Re: 1) اطلاعات عمومی
در مشخصات ارائه شده در زیر اطلاعات عمومی، ارزیابی خطر تجهیزات پزشکی توصیه شده توسط دستورالعمل مؤسسۀ رابرت کخ (RKI) تأیید شده است. بر این اساس، RUMED بر اساس دستورالعمل شمارۀ 4 wfhss (مفهوم RUMED) تقسیمبندی میشود.
| نام و آدرس اپراتور: | |
| بالاترین کلاس خطر تجهیزات پزشکی (MDs) مستلزم پردازش مجدد | ☐ نیمهبحرانی A ☐ نیمهبحرانی B ☐ بحرانی A ☐ بحرانی B ☐ بحرانی C |
| بر این اساس به گروه RUMED منطبق بر دستورالعمل شمارۀ 4 wfhss تخصیص داده میشوند. | ☐ 1 ☐ 2 ☐ 3 |
| مسئول استریلیزاسیون: |
علاوه بر این، مسئولیت مدیریت RUMED تأیید میشود.
Re: 2) وضعیت ساختاری / فضایی
| بلی | خیر | ملاحظات | |
| محل اختصاصی موجود است؟ | Rumed II، III | ||
| تقسیمبندی ناحیۀ فضایی به غیرتمیز / تمیز / استریل؟ | Rumed II | ||
| تقسیمبندی ناحیۀ ساختاری به غیرتمیز / تمیز / استریل؟ | Rumed III (ساخت و ساز جدید) | ||
| تنها تقسیمبندی ناحیۀ ساختاری به غیرتمیز + تمیز / استریل؟ | هدف Rumed III (همچنین ساختمان قدیمی) | ||
| دریچۀ غیرتمیز / تمیز؟ | Rumed III (ساخت و ساز جدید، حداقل درپوش گان) | ||
| دریچۀ تمیز / استریل؟ | Rumed III (در صورت نزدیکی به OR) | ||
| ناحیۀ غیرتمیز: ناحیۀ سطحی موجود کافی؟ | Rumed II، III | ||
| ناحیۀ تمیز: ناحیۀ سطحی موجود کافی؟ | Rumed II، III | ||
| رختکنهای جداگانه برای ناحیۀ تمیز / غیرتمیز؟ | |||
| نقایص ساختاری؟ | |||
| Rumed نزدیک به واحد عملیاتی؟ | |||
| ☐ Rumed ☐ واحد عملیاتی ☐ سایر موارد | |||
پاسخ به این سؤالات، مستلزم آن است که برنامههای وضعیت توسط مدیریت فنی کسب و کار تهیه شده و در RUMED نمایش داده شوند. برای اطمینان از وجود سطح کافی باید از مقررات محل کار نیز استفاده کرد؛ زیرا شرایط اساسی در اینجا تعریف میشود. در صورت لزوم باید با افسر ایمنی مربوطه و خدمات پزشکی شغلی نیز مشورت کرد.
پارامترهای زیر باید در مورد شرایط فضایی رعایت شوند (نسبتهای فضایی فرموله شده بر اساس راهاندازی)
| بلی | خیر | ملاحظات | |
| تسهیلات هوادهی / هواگیری اتاق موجود است؟ | ☐ | ☐ | |
| رطوبت محیطی در سمت بارگیری بیش از 30 درصد است؟ | ☐ | ☐ |
Re: 2.2) ابزارآلات و لوازم
| بلی | خیر | ملاحظات | |
| حوضچۀ شستشوی دست در منطقۀ غیرتمیز موجود است؟ | |||
| – ابزارآلات مناسب موجود است | |||
| پاککنندۀ فراصوت موجود است | |||
| – بازرسی معمولی (در صورت لزوم) | نوع: | ||
| دستگاه شستشو – ضدعفونیکننده (WD) موجود است | مانند: تجهیزات پزشکی نیمهبحرانی B | ||
| – ظرفیت WD کافی است | |||
| – فرآیندهای WD اعتبارسنجی شدهاند | |||
| درزگیر دوار موجود است | مانند: تجهیزات پزشکی بحرانی A | ||
| – بازرسی معمولی | نوع: | ||
| دستگاههای استریلکننده موجود هستند | مانند: تجهیزات پزشکی بحرانی A | ||
| – استریلکننده (های) با بخار – بزرگ؟ | تعداد: ☐ طبق EN 285 | ||
| – استریلکننده (های) با بخار – کوچک | تعداد: ☐ طبق EN 13060 | ||
| – استریلکنندههای در دمای پایین | نوع: تعداد: |
توصیه میشود که لیستی از تجهیزات را برای این بلوک تهیه کنید. برای انجام این کار، پارامترهای اساسی، مانند: ظرفیت، سال تولید، مبنای تستهای نصب را از مستندات فنی وارد کنید. هرگونه گزارش تست را در تستهای نصب یا تستهای گذشته ثبت کنید.
کاهش دامنۀ راهاندازی برای بازرس یا کمک به RUMED، برای تصمیمگیری در مورد اعتبار فرآیند دستگاهها، مستلزم آن است که RUMED در ابتدا، ضمن مشورت با خدمات فنی بیمارستان مربوطه، مسائل زیر را از بخش «راهاندازی» B روشن کند:
پیششرطهای فنی برای اعتبارسنجی دستگاههای استریلکنندۀ عرضه شده، قبل از EN 285 و EN 13060 به ترتیب اعمال میشوند:
| بلی | خیر | ملاحظات / متغیرها | |
| آیا دستگاه استریلکننده با بخار آزمایشی، دارای مرکز اندازهگیری فشار مطلق، برای ثبت فشار در محفظۀ استریلکننده هست؟ | ☐ | ☐ | |
| آیا دستگاه استریلکننده با بخار آزمایشی، مجهز به برنامۀ تست خودکار بووی و دیک هست؟ | ☐ | ☐ | |
| آیا دستگاه استریلکننده با بخار آزمایشی، مجهز به برنامۀ تست خلأ خودکار هست؟ | ☐ | ☐ | |
| آیا برنامههای دستگاه استریلکننده با بخار آزمایشی، مجهز به فرآیند خلأ پالسی (تفکیک شده) یا فرآیند معادل آن هست؟ | ☐ | ☐ | |
| آیا اتصالات مورد نیاز برای نصب ابزارهای اندازهگیری آزمایشی موجود هست؟ | ☐ | ☐ | |
| آیا دستگاه استریلکننده با بخار، دارای قابلیت ثبت اندازهگیری طولانی مدت فشار و دمای محفظه هست؟ | ☐ | ☐ | ☐ آنالوگ ☐ دیجیتال ☐ الکترونیک |
| دو حسگر دمای مستقل از یکدیگر برای کنترل و نمایش / ثبت با اتصال، به ترتیب منطبق بر EN 285 و EN 13060 هست؟ | ☐ | ☐ | |
| سیگنالدهی خطا و وقفه در فرآیند در صورت | |||
| – انحراف از پارامترهای فرآیند (>1K) | ☐ | ☐ | |
| – نقص در تأمین مواد عملیاتی | ☐ | ☐ | |
| – افت فشار در کابلهای آببندی درب | ☐ | ☐ | |
| ابزار اندازهگیری برای نمایش فشار / دمای محفظه و فشار غلاف موجود است؟ | ☐ | ☐ | |
| شمارندۀ محموله موجود است؟ | ☐ | ☐ | |
| دربهای مشترک برای دستگاههای دو درب؟ | ☐ | ☐ | |
| آیا خطوط لولۀ مادۀ استریلکننده از فولاد ضد زنگ ساخته شده است؟ | ☐ | ☐ | |
| نقطۀ نمونهبرداری تعریف شده برای میعانات بخار موجود است؟ | ☐ | ☐ |
☐ فیلدهایی که «بله» در پسزمینه نمایش داده شده است، مشخصات اجباری هستند.
Re: 2.3) سازمان
| بلی | خیر | ملاحظات / متغیرها | |
| آیا نمودار سازمانی بهروز شدهای در دسترس است؟ | RUMED III | ||
| آیا مشخصات مکتوب در مورد مسئولیتها و صلاحیتها موجود است؟ | RUMED II، III | ||
| آیا صلاحیت ترخیص مشخص شده است؟ | |||
| آیا صلاحیت ترخیص ویژه مشخص شده است؟* | |||
| آیا نظارت کارشناس دائمی (مدیر یا معاون مدیر) در محل تضمین میشود؟ | به عنوان مثال: خدمات کشیک | ||
| آیا واحد، «MD»ها را برای سایر مؤسسات پردازش مجدد میکند؟ | |||
| – طبقهبندی RUMED برای آن مؤسسه چیست؟ | |||
| – «MD»ها به کدام گروههای خطر RKI تعلق دارند؟ | |||
| – آیا قراردادها موجود است؟ |
* نمونهای از ترخیص ویژه: کاغذ چاپگر در مرحلۀ خشک کردن تمام شده است.
توصیه میشود که تمام دستورالعملها و اسناد مورد نیاز در کتاب راهنمای QM جمعآوری شود. مسائل اساسی سازمانی، مانند: نمودار سازمانی یا تخصیص کتبی مسئولیتها و صلاحیتها از قبل در مقدمۀ این کتاب راهنمای QM بررسی شده است.
شرح شغل برای تعریف صلاحیتها و مسئولیتها نیز مفید است. شرح شغل برای کارکنان مربوطه طراحی شده و تمامی موضوعات مرتبط، مانند: وظایف، صلاحیتها، اختیارات و نیابتها را مشخص میکند. در ادامه، نمونهای از شرح شغل آورده شده است و مهمترین عناصر را برجسته میکند.
نمونۀ شرح شغل
| صفحۀ 1 از 1 | شرح شغل |
| 1) صاحب شغل
2) ناحیه یا پروژه 3) مخفف مورد 2 4) تعیین شغل |
| 5) اختیارات امضاءکننده |
| 6) سرپرست
7) معاون سرپرست 8) سرپرست (متخصص) 9) معاون سرپرست (متخصص) 10) سمتهای تابعه 11) صاحب شغل تعویض خواهد شد 12) صاحب شغل جایگزین میشود |
| 13) اهداف شغلی |
| 14) مشخصات مورد نیاز |
| 15) وظايف تخصصی محول شده به صاحب شغل
علاوه بر اين، وظايفی كه در اينجا ذكر نشده و به تبع آن و ماهیتاً به اين حوزه مربوط نیستند، نيز بايد انجام شود. |
| 16) مسئولیت فرآیند در راستای مدیریت کیفیت |
| 17) مسئولیت سیستمها، عملکردها و رویهها |
| 18) امضاء با تاریخ:
سرپرست ناحیه صاحب شغل |
| لیست توزیع: اصل: سرپرست کپی: صاحب شغل، QM |
Re 2.4) صلاحیت / آموزش کارکنان
| بلی | خیر | ملاحظات | |
| مدیر / معاون مدیر | نام: | ||
| صلاحیت پایه با توجه به مقررات ملی | |||
| آموزش تخصصی | به مفهوم RUMED مراجعه کنید (راهنمای شماره 03 wfhss) | ||
| دورۀ تخصصی 1 | یا آموزش معادل | ||
| دورۀ تخصصی 2 | یا آموزش معادل | ||
| دورۀ تخصصی 3 | یا آموزش معادل | ||
| حداقل یک سال تجربۀ پردازش مجدد تجهیزات پزشکی | |||
علاوه بر شرح شغل، میتوان مشخصات مورد نیاز را نیز برای هر موقعیت سازمانی تدوین کرد. سطح دانش و تجربۀ لازم در مشخصات مورد نیاز تعریف میشود. مشخصات مورد نیاز، تشخیص لزوم آموزش اضافی یا توسعۀ حرفهای مستمر (CPD) را به شدت تسهیل میکند؛ مشخصات مورد نیاز مبنای خوبی برای انتخاب کارمندان جدید هستند.
جلسات منظم کارکنان یکی از روشهای دیگر ثبت هرگونه نیاز به آموزش یا CPD است. چنین جلساتی میتواند بین کارمند و سرپرست و به دور از فعالیتهای معمول برگزار شود.
| کارمند | |||
| تعداد کارکنان اضافی | |||
| چه تعداد از آنها حداقل دورۀ تخصصی 1 یا آموزش معادل آن را پشت سر گذاشتهاند؟ |
مدارک شرکت در دورههای آموزشی باید برای کارمند و سرپرست مربوطه مستند باشد. تمامی اطلاعات مربوط به اقدامات، مدت زمان، آموزشدهنده و دانش ارائه شده باید به درستی ثبت شود.
تجربه نشان داده است که حفظ سوابق آموزشی فردی کارکنان بسیار مفید است. هر سمینار آموزشی در این گزارش ثبت میشود و توسط مربی تأیید میگردد. مزیت روش فوق این است که هر کارمند، به هنگام تغییر شغل، میتواند گزارش را به سرپرست بعدی ارائه کند و بر اساس دورههای آموزشی گذرانده شدۀ قبلی، به مسیر شغلی خود ادامه دهد.
حفظ سوابق آموزش و احتمالاً مشخصات مورد نیاز، به تسهیل مقایسۀ این اطلاعات با سطح دانش مورد نیاز برای موقعیت (جدید) منجر خواهد شد.
آموزش
| بلی | خیر | ملاحظات | |
| آیا برنامۀ آموزشی موجود است؟ | |||
| – آیا این برنامه بهروز شده است؟ | |||
| آیا محتوای آموزشی برای کارکنان جدید تعریف شده است؟ | |||
| – آموزش بهداشت (کنترل عفونت)؟ | |||
| – آموزش ایمنی شغلی؟ | |||
| – آموزش تجهیزات؟ | |||
| آیا سوابق انتصاب رسمی موجود است؟ | |||
| سطح دانش موجود چگونه مشخص میشود؟ | |||
| بررسیهای نقطهای برای تعیین سطح دانش کارکنان انجام میشود؟ |
Re :2.5) بهداشت عمومی (کنترل عفونت)
| بلی | خیر | ملاحظات | |
| آیا خطمشی (پوشه) بهداشتی (کنترل عفونت) موجود است؟ | |||
| خطمشی پاکسازی و ضدعفونی موجود است؟ | |||
| – آیا بهروز است؟ | |||
| – آیا محصولات موجود هستند؟ | |||
| – محصولات فهرست شده (مورد تأیید)؟ | |||
| دستورالعمل بهداشت فردی؟ | |||
| دستورالعمل بهداشت دست؟ | |||
| دستورالعمل در مورد اتاقهای رختکن / دریچهها؟ |
اپراتور RUMED باید:
- تمام مواد کار مورد استفاده را فهرست کند.
- اقدامات بهداشت دست مورد نیاز را تعریف کرده و آموزش دهد.
- دستورالعملهای تعویض لباسهای کار در اتاق تمیز را تعریف کرده و از ورود کارمندان به صورت مستند اطمینان حاصل نماید.
Re: 2.6) ایمنی شغلی
| بلی | خیر | ملاحظات | |
| آیا واکسن هپاتیت B ارائه میشود؟ | |||
| آیا برگههای اطلاعات ایمنی برای مواد شیمیایی مورد استفاده در دسترس هست؟ | |||
| آیا بروشورهایی در مورد اقدامات لازم در صورت بروز حوادث مربوط به مواد بیولوژیکی موجود هست؟ | |||
| آیا سیستمی برای گزارش حوادث مربوط به مواد بیولوژیکی وجود دارد؟ | |||
| آیا تجهیزات حفاظت فردی (PPE) موجود هست؟ | |||
| – دستکش؟ | |||
| – گان؟ | |||
| – پیشبند؟ | |||
| – ماسکهای دهان و صورت؟ | |||
| – عینک ایمنی؟ | |||
| آیا ذخیرۀ کافی از PPE موجود است؟ | |||
| آیا PPE به درستی استفاده میشود؟ | |||
| آیا آموزش ایمنی شغلی سالانه ارائه میشود؟ |

مواد خطرناک، مواد و فرآوردههایی هستند که یک یا چند ویژگی خطرناک را نشان میدهند.
ویژگیهای خطرناک عبارتاند از:
- منفجره
- قابل احتراق
- به شدت منفجره
- کمی منفجره
- قابل اشتعال
- به شدت سمی
- سمی
- خورنده
- محرک
- حساسیتزا
- سرطانزا
- تراتوژن
- جهشزا
- خطرناک برای محیط زیست
- خطرناک برای سلامتی
برگههای دادههای ایمنی برای تمام مواد کاری ذکر شده در بالا را از تولیدکننده بخواهید.برگههای دادههای ایمنی، اطلاعاتی را در مورد ماهیت و اجزای تشکیلدهندۀ مواد، شرایط نگهداری، اقدامات لازم به هنگام کار با مواد PPE (تجهیزات حفاظت شخصی) مورد استفاده ارائه میدهد.

مواد کار، مواد عملیاتی
دستورالعملهای عملیاتی
هنگام استفاده از ابزارها، ماشینآلات، مواد کار و فرآیندهای خطرناک به دستورالعملهای عملیاتی نیاز است.
دستورالعملهای عملیاتی به عنوان منبای کار کارکنان عمل میکند.
دستورالعملهای عملیاتی و دفترچههای راهنما باید به زبان اپراتور موجود باشد.
دستورالعملهای عملیاتی باید حداقل حاوی اطلاعات زیر باشد:
- شرایط استفادۀ معمول
- استفادۀ مورد نظر
- اقدامات لازم در صورت بروز نقص عملکردی
- دستورالعملهای تولیدکننده در دفترچۀ راهنمای عملیات
دستورالعملهای مناسب مربوط به گزارش و ثبت حوادث و رویدادهای نزدیک به حوادث باید تدوین شده و کارکنان بر این مبنا آموزش ببینند.

کلیات
گزارش حوادث محل کار
حوادث در محل کار چه هستند؟
حادثه در محل کار، حادثهای است که در محل کار یا در راه رفتن به محل کار یا برگشتن از آن تجربه میشود.
در صورت بروز حادثه در محل کار به چه اقداماتی نیاز است؟
- کمکهای اولیه
- درمان پزشکی (در صورت لزوم)
- گزارش به کارفرما (سرپرست)
دلیل اهمیت زیاد این گزارش چیست؟
- بهترین درمان ممکن را به شما ارائه میدهد.
- در صورت وجود آسیب پایدار، شما از حق بازآموزی یا مطالبۀ مستمری از کار افتادگی برخوردار خواهید بود.
- به دفع خطرات دیگر در آینده کمک میکند.
- با گزارش رویدهای نزدیک به حوادث میتوان از حوادث جدی جلوگیری کرد!
Re: 3) تضمین / مدیریت کیفیت
Re: 3.1) کلیات
| بلی | خیر | ملاحظات | |
| آیا طبقهبندی خطر «MD»ها بر اساس RKI رعایت شده است؟ | |||
| آیا دستورالعمل تولیدکننده در مورد پردازش مجدد موجود است؟ | تا حد ممکن (لزوم) | ||
| در هنگام خرید «MD»ها به این نکته توجه میشود که آیا میتوان آنها را تحت پردازش مجدد قرار داد؟ | |||
| – آیا دستورالعملهای کتبی در این زمینه وجود دارد؟ | |||
| آیا دستورالعملهای کتبی در ارتباط با موارد زیر وجود دارن؟ | |||
| – تدوین سند؟ | |||
| – بازرسی سند؟ | |||
| – انتشار سند؟ | |||
| آیا گزارشهای تست آزمایشهای قبلی موجود هست؟ | |||
| – WD؟ | |||
| – دستگاههای استریلکننده؟ | |||
| آیا برنامۀ نگهداری موجود است؟ | |||
| – WD؟ | |||
| – دستگاههای استریلکننده؟ | |||
| – پاککنندۀ فراصوت؟ | |||
| – دستگاه آببندی؟ | |||
| – ژنراتور بخار؟ | |||
| – سیستم اسمز معکوس آب؟ | |||
| آیا این دستورالعملها رعایت شده و مستند هستند؟ |
در ادامه، روش ارزیابی خطر و طبقهبندی تجهیزات پزشکی از نظر قابلیت پردازش مجدد توضیح داده میشود.
شرایط لازم برای انتشار سند در این موضوعات نیز به تفصیل در ادامه شرح داده خواهد شد.
نکتۀ دیگری که باید به آن اشاره شود، لزوم توجه به این موضوع در زمان خرید ابزارها است که: «آیا میتوان این تجهیزات را تحت پردازش مجدد قرار داد یا خیر و نحوۀ آن چگونه است؟» این امر، بدان معناست که مدیریت RUMED باید در فرآیند تدارکات بیمارستان مشارکت داشته باشد.
طبقهبندی گروههای خطر بر اساس RKI:
چکلیست بالا همچنین بیان میکند که برنامههای نگهداری باید برای تمامی تجهیزات و سیستمهای مورد استفاده در فرآیند پردازش مجدد تهیه شود. مسئولیت تدوین برنامههای نگهداری بر عهدۀ شخص یا اشخاص مسئول سیستمهای مختلف است. با این حال، بخش مهندسی بیمارستان نیز باید در تنظیم فواصل نگهداری، تعریف وظایف و استراتژیهای نگهداری، مشارکت داشته باشد.
هنگام بازبینی فعالیتهای نگهداری، باید به اطمینان از کالیبراسیون منظم تجهیزات اندازهگیری و سیگنالدهی نیز توجه شود؛ زیرا امکانات نمایش عملکردی برای ارزیابی نتایج استریلیزاسیون و در نتیجه ترخیص محموله ضروری است.
Re :3.2) دستگاههای شستشو – ضدعفونیکننده (WDs)
| بلی | خیر | ملاحظات | |
| آیا برنامۀ بازرسی معمول وجود دارد؟ | |||
| آیا بازرسیهای معمول انجام میشوند؟ | |||
| – با توجه به انسداد (آندوسکوپ، ابزار MIS و غیره)؟ | |||
| – با توجه به پاکسازی؟ | ☐ بازرسی چشمی
☐ نشانگر پاکسازی ☐ تشخیص پروتئین |
||
| – با توجه به ضدعفونی؟ | ☐ تستهای ترمومتریک منظم
☐ بررسی چشمی دما (نمایشگر WD) ☐ سایر موارد: |
||
| – دوز مواد شیمیایی فرآیند؟ | ☐ خط روی قوطی
☐ مستندسازی تغییر مواد شیمیایی ☐ سایر موارد: |
||
| – بازرسی بازوهای دوار در بارگیری و تخلیه؟ | تا حد ممکن | ||
| آیا مستندسازی محموله انجام شده است؟ | |||
| – به اندازۀ کافی جامع و مستمر بوده است؟ |
Re: 3.3) دستگاههای استریل کننده
| بلی | خیر | ملاحظات | |
| آیا برنامۀ بازرسی معمول وجود دارد؟ | |||
| آیا بازرسیهای معمول انجام میشوند؟ | |||
| – تست خلأ (حداقل هفتگی)؟ | |||
| – تست نفوذ بخار (تست بووی – دیک) – روزانه؟ | |||
| – سیگنالدهی انطباق با مشخصات چرخۀ استریلیزاسیون؟ | به عنوان مثال: تستهای ترمومتریک دورهای | ||
| آیا مستندسازی محموله انجام شده است؟ | |||
| – سیستم کنترل محموله (PCD)؟ | |||
| – به اندازۀ کافی جامع و مستمر است؟ |
اطمینان از اجرای تستهای معمول به شیوهای مناسب و ایجاد نتایج مقایسهای، مستلزم آن است که روش مورد استفاده برای هر تست واحد در دستورالعملهای آزمون توضیح داده شود. همان قالب مورد استفاده برای دستورالعملهای عملیاتی (استاندارد- SOP) در دستورالعملهای تست نیز استفاده میشود. اما یک تفاوت مهم در دستورالعملهای تست وجود دارد: «تعریف معیارهای پذیرش و رد، یعنی؛ نتیجۀ آزمون منقطع مشخص کنندۀ رد یا قبول نتیجۀ آزمون (و در نتیجه امکان ادامۀ استفاده از سیستم) چیست؟»
Re :3.4) ذخیرهسازی لوازم استریل
| بلی | خیر | ملاحظات | |
| ذخیرهسازی در ضمن حفاظت در برابر گرد و غبار؟ | |||
| پایایی تعریف شده؟ |
Re: 3.5) رویههای عملیاتی استاندارد (SOP)
| بلی | خیر | ملاحظات | |
| آیا رویههای عملیاتی استاندارد برای موارد زیر موجود هست: | |||
| مدیریت تجهیزات پزشکی پس از استفاده؟ | |||
| – نحوۀ مدیریت (انتقال) تجهیزات پزشکی، پس از استفاده؟ | |||
| – حداکثر زمان مجاز به صبر کردن تا پردازش مجدد «MD»ها؟ | ساعت | ||
| پیشتیمار در محل استفاده (به عنوان مثال: OR)؟ | |||
| حمل و نقل «MD»های آلوده؟ | |||
| مسئولیت لوازم ورودی در RUMED (بازرسی ورودی)؟ | |||
| دستورالعمل پیادهسازی؟ | |||
| پیشپاکسازی دستی؟ | |||
| پاکسازی فراصوت؟ | |||
| دستگاه شستشو – ضدعفونی (WDs)؟ | |||
| – دستورالعملهای بارگیری WD؟ | |||
| – انتخاب برنامه؟ | |||
| – بازرسی؟ | |||
| – معیارهای ترخیص؟ | |||
| – رویۀ عدم انطباق با معیارهای ترخیص؟ | |||
| – رویه در صورت بروز نقص؟ | |||
| – رویه در صورت ایراد؟ | |||
| تست عملکردی؟ | |||
| مراقبت؟ | |||
| بستهبندی؟ | |||
| دستگاههای استریلکننده؟ | |||
| – دستورالعمل بارگیری دستگاه استریلکننده؟ | |||
| – انتخاب برنامه؟ | |||
| – بازرسی؟ | |||
| – معیارهای ترخیص؟ | |||
| – رویۀ عدم انطباق با معیارهای ترخیص؟ | |||
| – رویه در صورت بروز نقص؟ | |||
| – رویه در صورت ایراد؟ | |||
| حمل و نقل «MD»های استریل؟ | |||
| ذخیرهسازی؟ | |||
| استفاده؟ | |||
| جابجایی کوتاه لوازم استریل؟ |
ساختار دستورالعملهای عملیاتی استاندارد (SOP) در مطالب قبل توضیح داده شده است و تمرینهای عملی در دورۀ تخصصی 1 (SC I) انجام شده است. برای توضیح نحوۀ انطباق «SOP»ها با خواستههای مختلف مشخص شده در دستورالعمل اعتبارسنجی، نمونۀ SOP مورد استفاده در SC I مجدداً در ادامه آورده شده است.
|
«نمونۀ» بیمارستانی |
رویۀ عملیاتی استاندارد | شمارۀ سند | AA-XY |
| عنوان: آمادهسازی محلول ضدعفونیکنندۀ سطحی | بازبینی: | 00 | |
| معتبر از: |
این روش عملیاتی استاندارد، تهیۀ مواد ضدعفونیکنندۀ سطح برای منطقۀ XY را توصیف میکند.
2: محدوده / محل کار
منطقۀ تهیه و استفاده از محلول را مشخص کنید.
3: اصطلاحات
ml = میلیلیتر
L = لیتر
4: صلاحیتها
مشخص کنید چه کسی مسئول این کار است؟
5: رویه
محلول 5/0٪ باید به عنوان تمرین استاندارد تهیه شود.
سایر غلظتها برای مناطق کاربردی خاص، توسط پرستار مسئول واجد شرایط مشخص شده است.
1-5: ظروف
- حوضچۀ پاکسازی، سبز، از چرخدستی پاکسازی
- مادۀ ضدعفونیکننده (ظرف 5 لیتری با پمپ دوز)
- بشر دوز کوچک با درجهبندی دقیق (علامتگذاری شده)
2-5: روش
- محلول تازه باید هر روز صبح تهیه شود.
- جدول دوز در داخل کابینت بالای شیر آب اتاق «دفع غیرتمیز» نصب شده است.
- 8 لیتر آب (خنک) داخل حوضچه بریزید (علامتگذاری روی لبۀ داخلی حوضچه).
- سپس دوز مناسب مادۀ ضدعفونیکننده را با پمپ دوز در بشر کوچک اندازهگیری بریزید.
- بررسی کنید که دقیقاً 40 میلیلیتر باشد.
- حال، 40 میلیلیتر را به آب اضافه کنید.
3-5: استفاده
- محلول را تنها میتوان برای یک روز استفاده کرد.
- هرگز نباید پارچۀ استفاده شده را در محلول فرو کنید.
- رطوبت سطوح پاک میشود.
6: حفاظت از پرسنل
- هنگام تهیۀ محلول باید از دستکش، ماسک دهان و صورت و عینک استفاده کرد.
- همواره، هنگام کار با محلول باید از دستکش استفاده نمود.
- هر یک از کارکنان باید در مورد خطرات ناشی از مواد کار آموزش ببینند.
- هر یک از کارکنان باید با اقدامات کمکهای اولیۀ مبتنی بر برگۀ اطلاعات ایمنی آشنا باشند.
7: عیبیابی
- تاریخ انقضاء را بررسی کنید.
- پس از حوادث یا رویدادهای نزدیک به حادثه، اقدامات ذکر شده در دستورالعملهای معتبر خدمات مؤسسۀ مربوطه را انجام دهید.
8: سایر مستندات
- خطمشی بهداشتی (کنترل عفونت)
- دستورالعملهای خدمات
- برگۀ دادههای ایمنی
اما میتوان «SOP»ها را در قالبهای دیگری نیز تهیه کرد. لیستهای بستهبندی یا مستندات عکاسی مجموعهها، دارای همان ویژگی SOP نمونۀ فوقالذکر هستند. باید فرمتی از SOP را انتخاب کرد که هدف و تناسب آن را به بهترین نحو منعکس میکند.
صرفنظر از فرمت، همیشه باید وضعیت مشکل و یادداشتهای ترخیص را ارائه کرد تا همواره امکان ارزیابی اعتبارسنجی فراهم باشد.
Re 3.6) مستندات
| بلی | خیر | ملاحظات | |
| آیا مستندات زیر در دسترس هستند؟ | |||
| ضدعفونی سطوح؟ | |||
| بازرسی منظم WD؟ | |||
| مستندات محموله WD؟ | |||
| بازرسیهای معمول استریلیزاسیون؟ | |||
| مستندات محمولۀ استریلیزاسیون؟ | |||
| – ترخیص پارامتریک؟ | |||
| نقص عملکردی؟ | |||
| خطاها / خطاهای نزدیک؟ | |||
| خدمات داخلی؟ | |||
| خدمات خارجی؟ | |||
| بازرسیها / تستها، داخلی (مانند: ممیزیهای داخلی، ارزیابی نیازهای آموزشی)؟ | |||
| بازرسیها / تستها، خارجی (مانند: بازرس فنی، اعتبارسنجی، ممیزی خارجی، بازرسی بهداشتی)؟ | |||
| بازخورد از مخاطبان یا سایرین؟ |
اسناد (مدارک مشخص شده) و سوابق، در مدیریت کیفیت از یکدیگر متمایز میشوند. سوابق، اسنادی هستند که بر اساس مراحل فرآیند فردی جمعآوری میشود و به عنوان مدرکی برای انجام منظم شیوههای کاری عمل میکند.
اصطلاحات مورد استفاده در مدیریت کیفیت
مستندات
- تعریف استانداردها
- تعریف مسئولیتها
- اسناد و مدارک ردیابی
- حائز اهمیت برای مسئولیت محصول
سوابق
- سوابق آزمون
- حائز اهمیت برای مسئولیت محصول
- حائز اهمیت برای اعتبارسنجی
هنگام تهیۀ سوابق باید بینشهای ارائه شده حفظ شود؛ زیرا سوابق میتواند در آینده مشخص کند که آزمایشها، ترخیص و سایر موارد به درستی انجام شده است. به این ترتیب، سوابق در صورتی مهم هست که مسائل مربوط به مسئولیت محصول مطرح شود. همچنین نباید فراموش کرد که دادههای رایانهای نیز در سابقه ثبت میشوند و باید موارد زیر را برای دادههای رایانهای مشخص کرد: «چه کسی مجاز به کار با برنامه است و دادهها باید چگونه و در کدام رسانۀ منبع ذخیره شود؟» اهمیت این امر از احتمال ناخوانا شدن احتمالی دادههای رایانهای، در طی زمان نشأت میگیرد. دورۀ نگهداری سوابق از یک طرف توسط قانون مسئولیت محصول تنظیم میشود یا در صورت ارتباط دادهها با بیمار، دورۀ نگهداری اسناد بیمار اعمال میگردد. نوع مقررات اعمال شده باید با همکاری بخش حقوقی بیمارستان مربوطه تعیین شود.
آنالیز اندازهگیری، بهبود
نظارت و اندازهگیری
مدیریت محصولات ناسازگار
نظارت و اندازهگیری به طور مفصل در بخش استانداردها توضیح داده شده است (آزمونهای بووی و دیک، تست خلأ، اعتبارسنجی)
مدیریت محصولات ناسازگار، یکی از جنبههای مهم پردازش مجدد تجهیزات پزشکی است. ناسازگاری، به معنای «عدم انطباق با الزامات» است. بنابراین باید مشخص شود که: «چگونه میتوان اقدامات صورت گرفته برای اطمینان از عدم استفاده از محصول غیراستریل یا حتی ارسال برای فرد را اجرا کرد؟»
رایجترین راه انجام این کار، استفاده از شاخصهای فرآیند است.
فرآیندهای مرتبط با مخاطب
محصولات (تجهیزات پزشکی) RUMED، دارایی مخاطبان هستند و توسط مخاطب برای ارائۀ خدمات استفاده میشود. بنابراین، هر RUMED، باید این سؤالات را نیز مطرح کند: «مخاطبان چه کسانی هستند؟»، «مخاطبان چه نیازهایی دارند؟» و بدین ترتیب باید یک فرآیند ارتباطی با تمامی مخاطبان برقرار شود. کارمندان RUMED، در صورت اجرای مناسب آنالیز، قادر خواهند بود تا میزان پیچیدگی فرآیندهای اصلی خود و چگونگی ادغام آنها در فرآیندهای مخاطبان را درک کنند. همانطور که توضیح داده شد، رابطها با مخاطبها از اجزای کلیدی فرآیند هستند و باید به طور مستمر نظارت شوند. در اینجا اطلاعاتی مبنی بر عملکرد مناسب فرآیندهای شخصی از مخاطب دریافت میشود. ارتباط با مخاطب یکی از ورودیهای مهم برای بهینهسازی فرآیندهای خود با استفاده از اصل کنترل فرآیند توصیف شده در بخش 4-6 است.
پیوست
استانداردها
دستگاههای استریلکننده، تجهیزات پزشکی کلاس IIa (طبق مادۀ 10، پیوست IX، 93/42/EEC) برای استریلیزاسیون وسائل پزشکی در بخش مراقبتهای بهداشتی هستند.
مهم است که اپراتور دستگاههای استریلکننده نیز با استانداردهای مربوطه آشنا باشد.
اهمیت استانداردها توسط دستورالعمل تجهیزات پزشکی 93/42/EEC و قانون هماهنگ تجهیزات پزشکی اتریش (MPG) مورد تأیید قرار گرفته است. آنها (حداقل) پیشرفتهترین وضعیت را مشخص میکنند و این وضعیت باید توسط سازنده به هنگام طراحی، تولید، بهرهبرداری یا استفاده از وسائل پزشکی رعایت شود.

